Chào các em học tập sinh, từ bây giờ Kiến Guru chia sẻ đến những em bài viết về bảng tuần hoàn nguyên tố hóa học rất đầy đủ nhất. Bảng yếu tố là 1 phần rất đặc trưng giúp bọn họ biết các chất nằm ở vị trí đâu, nằm trong chu kì nào, có hóa trị từng nào và không chỉ có vậy là giúp cho các em đọc được cấu trúc và nguyên tắc của chúng. Vậy chúng ta ban đầu tìm gọi nhé!
I. Phép tắc sắp xếp những nguyên tố vào bảng tuần hoàn nguyên tố hóa học khá đầy đủ nhất
- những nguyên tố được xếp theo chiều tăng đột biến của năng lượng điện hạt nhân nguyên tử.
Bạn đang xem: Bảng nguyên tố hóa học đầy đủ nhất
- các nguyên tố bao gồm cùng số lớp electron vào nguyên tử sẽ được xếp thành một mặt hàng ở chu kì
- những nguyên tố tất cả cùng số e hóa trị trong nguyên tử được xếp thành một cột. (nhóm)
II. Bảng nguyên tử khối và kết cấu bảng tuần hoàn nguyên tố hóa học rất đầy đủ nhất
1.Bảng nguyên tử khối
2. Ô nguyên tố
Số sản phẩm tự của ô nguyên tố đúng thông qua số hiệu nguyên tử của nguyên tố kia (= số e = số p. = số đơn vị chức năng điện tích phân tử nhân).
3. Chu kì
Chu kì là dãy của những nguyên tố nhưng nguyên tử của bọn chúng cùng số lớp electron và sẽ tiến hành xếp theo chiều năng lượng điện hạt nhân tăng dần.
Số vật dụng tự của chu kì trùng với số lớp electron của nguyên tử những nguyên tố vào chu kì đó.
* Chu kì nhỏ: bao gồm chu kì 1, 2, 3.
* Chu kì lớn: gồm chu kì 4, 5, 6, 7.
Ví dụ:12Mg: 1s2/2s22p6/3s2.
→ Mg nằm trong chu kì 3 vì bao gồm 3 lớp electron.
4. Nhóm nguyên tố
- team nguyên tố là tập hợp những nguyên tố mà lại nguyên tử có cấu hình electron tựa như nhau, vì thế có đặc điểm hóa học gần giống nhau với được xếp thành một cột.
- Chỉ gồm 2 một số loại nhóm nguyên tố chính là nhóm A và nhóm B:
+ đội A sẽ bao hàm các nguyên tố s với p.
Số lắp thêm tự nhóm A = tổng thể e phần ngoài cùng.
+ team B sẽ bao gồm các thành phần d với f có cấu hình e nguyên tử tận cùng dạng (n – 1)dxnsy:
III. Quan hệ giữa địa chỉ của nguyên tố và cấu tạo nguyên tử của nó
Các cấu hình electron trong nguyên tử với vị trí của các nguyên tố kia trong bảng tuần trả có quan hệ qua lại cùng với nhau.
- Số thứ tự của ô yếu tố = tổng thể e của nguyên tử
- Số lắp thêm tự của chu kì = số lớp e
- Số thiết bị tự của nhóm:
+ Nếu cấu hình e phần bên ngoài cùng tất cả dạng nsanspthì nguyên tố thuộc nhóm (a+b) A
+ Nếu thông số kỹ thuật e ngừng ở dạng (n-1)dxnsythì yếu tắc thuộc nhóm B:
Nhóm (x+y)B ví như 3 ≤ (x + y) ≤ 7.
Nhóm VIIIB ví như 8 ≤ (x + y) ≤ 10.
Nhóm (x + y - 10)B trường hợp 10
IV. Quan hệ tình dục giữa địa điểm và đặc điểm của nguyên tố
Vị trí nguyên tố cho biết:
- các nguyên tố thuộc nhóm (IA, IIA, IIIA) trừ B cùng H tất cả tính kim loại. Các nguyên tố thuộc team VA, VIA, VIIA có tính phi kim (trừ Antimon, bitmut, poloni).
- Hoá trị cao nhất của thành phần với oxi, hóa trị cùng với hiđro.
- cách làm của oxit tối đa và hidroxit tương ứng
- phương pháp của hợp chất khí với H (nếu có)
- Oxit với hidroxit sẽ sở hữu được tính axit xuất xắc bazo.
Ví dụ:Cho biết S sống ô sản phẩm 16 suy ra:
- S ở đội VI, CK3, PK
- Hoá trị tối đa với oxi 6, với hiđro là 2.
- CT oxit cao nhất SO3, h/c với hiđro là H2S.
- SO3 là ôxit axit cùng H2SO4là axit mạnh.
V. So sánh đặc thù hoá học của một yếu tắc với các nguyên tố lạm cận
a. Vào chu kì theo chiều tăng của năng lượng điện hạt nhân:
- Tính kim loại yếu dần, tính phi kim bạo dạn dần.
- Tính bazơ, của oxit và hiđroxit yêú dần, tính axit to gan dần.
b. Trong đội A theo chiều tăng của năng lượng điện hạt nhân:
Tính kim loại mạnh dần, tính phi kim yếu hèn dần.
* lưu ý khi xác xác định trí những nguyên tố team B .
- Nguyên tố chúng ta d : (n-1)dansbvới a = 1 → 10 ; b = 1 → 2
+ giả dụ a + b
+ trường hợp a + b > 10 ⇒ (a + b) – 10 là số thự trường đoản cú của nhóm.
+ giả dụ 8 ≤ a + b ≤ 10 ⇒ yếu tắc thuộc nhóm VIII B
- Nguyên tố bọn họ f : (n-2)fansbvới a = 1 → 14 ; b = 1 → 2
+ nếu như n = 6 ⇒ nhân tố thuộc họ lantan.
+ trường hợp n = 7 ⇒ yếu tố thuộc chúng ta acti
Khối yếu tố (block)
Các nhân tố trong bảng tuần hoàn thuộc 4 khối: khối s, khối p, khối d với khối f
e sau cuối điền vào phân lớp nào ( theo thứ tự mức năng lượng ) thì nguyên tố ở trong khối đó
Đặc biệt yếu tắc H hiện thời được xếp tại vị trí là ngón IA với VIIA rất nhiều ở chu kì 1. Yếu tố He tuy nhiên có 2e lớp bên ngoài cùng nhưng mà được xếp ở nhóm VIIIA. Điều này trả toàn tương xứng vì H giống kim loại kiềm đều có 1e ở phần ngoài cùng cơ mà nó cũng giống các halogen bởi chỉ thiếu 1e nữa là đạt thông số kỹ thuật bền giống khí hãn hữu He: còn He mặc dù có 2e ở phần ngoài cùng cơ mà giống các khí thi thoảng khác là cấu hình e đó là bão hòa
Các em sẽ xem qua ý nghĩa sâu sắc của bảng tuần trả nguyên tố hóa học không thiếu nhất. Qua bài viết này, kiến Guru sẽ giúp các em hiểu được bảng tuần hoàn, hiểu được chân thành và ý nghĩa của nó. Hãy tham khảo và ghi lưu giữ nó để ôn tập thật giỏi các em nhé! Chúc các em học giỏi và đạt điểm trên cao trong kì thi sắp tới!
Thông qua bài viết này, shop chúng tôi muốn ra mắt đến bạn đọc những văn bản căn bản nhất của một Bảng tuần hoàn những nguyên tố hóa học để chúng ta học sinh tham khảo.
Từ thời học sinh khi bước vào học môn chất hóa học chắc không ai là không nghe biết Bảng tuần hoàn các nguyên tố hóa học. Nhưng mà để biết và mày mò về nó một cách cụ thể và rất đầy đủ nhất lại ko phải ai ai cũng làm được.
Thông qua nội dung bài viết này, chúng tôi muốn trình làng đến độc giả những nội dung căn phiên bản nhất của một Bảng tuần hoàn các nguyên tố hóa học.
Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Thời Trung cổ, loài người đã biết đến những nguyên tố vàng, bạc, đồng, chỉ, sắt, thủy ngân với lưu huỳnh. Năm 1649, loài tín đồ tìm ra yếu tố photpho. Đến năm 1869, mới có 63 nhân tố được kiếm tìm ra.
Năm 1862, J. Dobereiner nhận thấy trọng lượng nguyên tử của Stronti làm việc giữa cân nặng nguyên tử của nhị nguyên tố bari với canxi. Bộ cha nguyên tố thứ nhất này bao gồm tính chất tựa như nhau. Tiếp theo, những nhà kỹ thuật đã tìm kiếm ra các bộ cha khác bao gồm quy quy định tương tự.
Năm 1862, công ty địa chất Pháp De Chancourtois đã sắp xếp những nguyên tố hóa học theo chiều tăng của cân nặng nguyên tử lên một băng giấy (băng giấy này được quấn xung quanh hình trụ theo phong cách lò xo xoắn). Ông nhận ra tính chất của các nguyên tố giống như tính chất của những con số, và đặc điểm đó tái diễn sau từng 7 nguyên tố.
Năm 1864, John Newlands, bên hóa học Anh, vẫn tìm ra quy luật: mỗi nguyên tố hóa học đều diễn tả tính chất tương tự như như nguyên tố thứ 8 khi xếp những nguyên tố theo khối lượng nguyên tử tăng dần.
Năm 1860, nhà bác học người Nga Mendeleev đã lời khuyên ý tưởng thi công bảng tuần hoàn các nguyên tố hóa học. Năm 1869, thổ địa bố bạn dạng “Bảng tuần hoàn những nguyên tố hóa học” đầu tiên.
Năm 1870, công ty khoa học bạn Đức Lothar Mayer nghiên cứu chủ quyền cũng đã chỉ dẫn một bảng tuần hoàn các nguyên tố hóa học tựa như như bảng của Mendeleev.
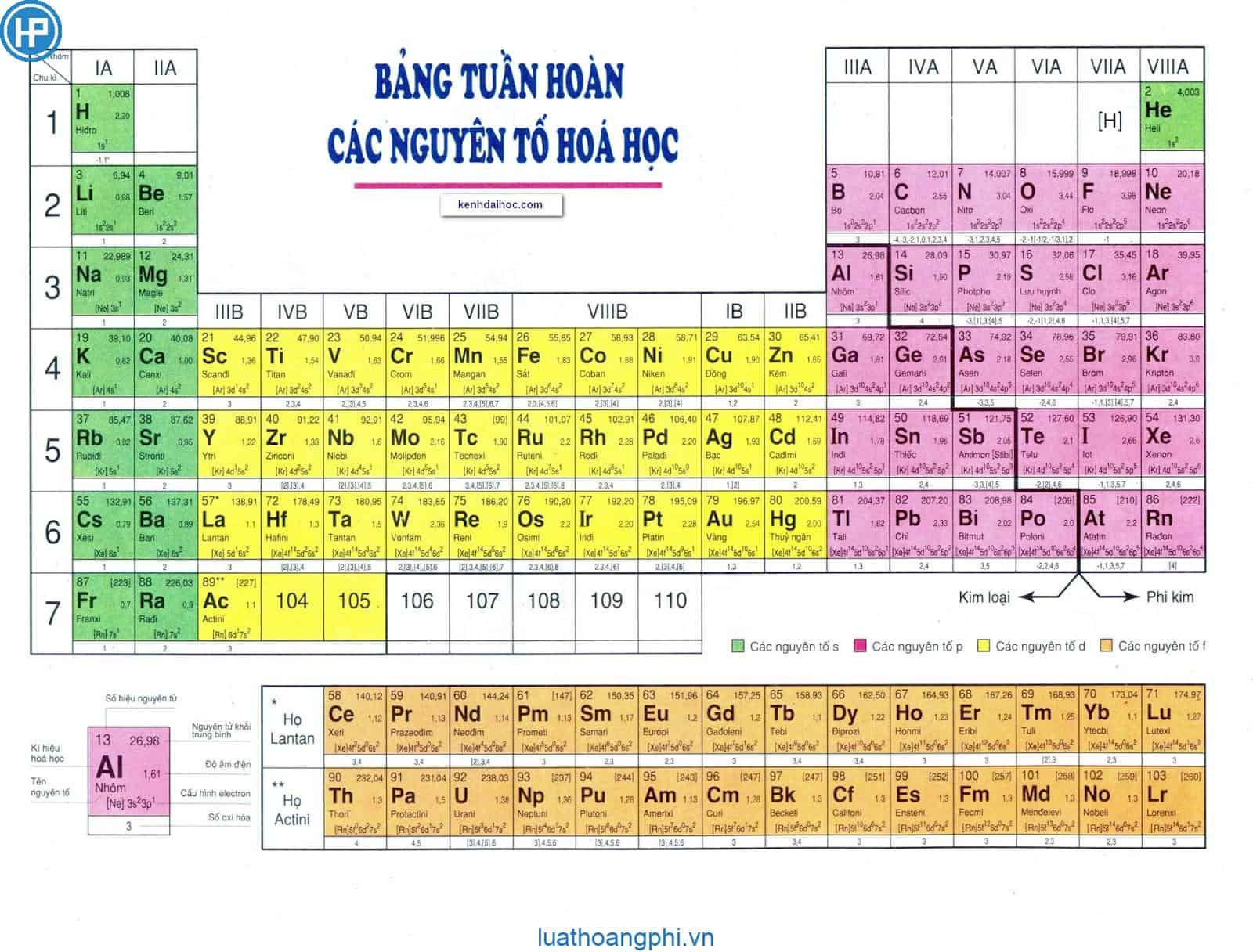
Cấu tạo thành của bảng tuần hoàn được chia thành ba phần chính
Thứ nhất: Ô nguyên tố
Ô nguyên tố cho biết: số hiệu nguyên tử, ký kết hiệu hóa học, thương hiệu nguyên tố, nguyên tử khối của thành phần đó.
Số hiệu của nguyên tử có số trị bởi số đơn vị điện tích hạt nhân và bằng số electron vào nguyên tử. Và số hiệu nguyên tử cũng là số sản phẩm tự của nhân tố trong bảng tuần hoàn.
Ví dụ: Số hiệu nguyên tử của Magie là 12 đến biết: Magie ở ô số 12, điện tích hạt nhân nguyên tử magie là 12+ (hay số đơn vị điện tích hạt nhân là 12), bao gồm 12 electron trong nguyên tử Magie.
Thứ hai: Chu kỳ
Chu kỳ là dãy những nguyên tố mà nguyên tử của chúng gồm cùng số lớp electron cùng được xếp theo chiều năng lượng điện hạt nhân tăng dần.
Số thứ tự của chu kỳ luân hồi bằng số lớp electron.
Bảng tuần hoàn bao gồm 7 chu kỳ, trong các số đó có những chu kỳ 1, 2, 3 được điện thoại tư vấn là chu kỳ luân hồi nhỏ, các chu kỳ 4, 5, 6, 7 được hotline là chu kỳ luân hồi lớn.
Xem thêm: Giá xoài đài loan giá bao nhiêu ? giá xoài đài loan khởi sắc
– chu kỳ luân hồi 1: bao gồm 2 nguyên tố là H với He, có một lớp electron tong nguyên tử. Điện tích phân tử nhân tăng từ H là 1+ mang đến He là 2+.
– chu kỳ 2: tất cả 8 yếu tắc từ Li đến Ne, gồm 2 lớp electron vào nguyên tử. Điện tích hạt nhân tăng từ Li là 3+, … cho Ne là 10+.
– chu kỳ luân hồi 3: có 8 yếu tố từ Na mang đến Ar, bao gồm 3 lớp electron trong nguyên tử. Điện tích phân tử nhân tăng cao từ na là 11+, … mang lại Ar là 18+.
– chu kỳ 4 và chu kỳ 5: từng chu kỳ đều phải có 18 nguyên tố, bắt đầu là một kim loại kiềm K là 19+ và Rb là 37+, xong là một khí hiếm Kr là 36+ và Xe là 54+.
– chu kỳ 6: tất cả 32 nguyên tố, bắt đầu từ kim loại kiềm Cs là 55+ và hoàn thành là khí thảng hoặc Rn là 86+.
– chu kỳ luân hồi 7: không hoàn thành.
Thứ ba: nhóm nguyên tố
Nhóm gồm các nguyên tố mà nguyên tử của chúng gồm số electron lớp ngoài cùng cân nhau và do đó có tính chất tương tự như nhau được xếp thành cột theo hướng tăng của năng lượng điện hạt nhân nguyên tử.
Số đồ vật tự của nhóm bằng số electron phần bên ngoài cùng của nguyên tử.
Có 2 nhiều loại nhóm nguyên tố là nhón A với nhóm B:
– đội A: bao gồm các yếu tố s và p Số máy nhóm A = tổng thể electron lớp bên ngoài cùng.
– team B: bao gồm các yếu tắc d với f có thông số kỹ thuật electron nguyên tử thì tận cùng ở dạng (n-1)dxnsy:
+ ví như (x+y) = 3 -> 7 thì yếu tố thuộc nhóm (x+y)B.
+ nếu (x+y) = 8 -> 10 thì nhân tố thuộc đội VIIIB.
+ giả dụ (x+y) > 10 thì yếu tố thuộc team (x+y-10)B
Ví dụ:
– team I: Gồm các nguyên tố kim loại chuyển động mạnh. Nguyên tử của bọn chúng đều có 1 electron ở phần bên ngoài cùng. Điện tích hạt nhân tăng tự Li (3+), … cho Fr (87+).
– team VII: Gồm những nguyên tố phi kim vận động mạnh. Nguyên tử của chúng đều phải có 7 electron ở lớp ngoài cùng. Điện tích phân tử nhân tăng trường đoản cú F (9+), … cho At (85+).
Bảng tuần trả hóa học tất cả bao nhiêu nguyên tố?
Tính cho tháng 9 năm 2021, bảng tuần hoàn hóa học có toàn bộ 118 nguyên tố đã làm được xác nhận, bao gồm các nguyên tố từ là một (Hidro) cho tới 118 (Oganesson).
Cùng với câu hỏi công dấn nguyên tố 113 là nguyên tố hóa học, Liên minh quốc tế về chất hóa học cơ bản và vận dụng (IUPAC) cũng đã chính thức chuyển 3 nguyên tố không giống với số hiệu nguyên tử lần lượt là 115, 117 và 118 vào bảng tuần hoàn. Đây được xem như như một “bản update lớn” của bàng tuần hoàn tính từ thời điểm năm 2011, khi 114 cùng 116 được đưa vào cùng giờ đây, chu kỳ 7 sẽ được phủ đầy, bảng tuần hoàn vẫn trở buộc phải đầy đặn hơn, giới hạn kiến thức và kỹ năng của trái đất lại được tiến them một bậc nhỏ dại và khả năng “tiên tri” cách đó gần 200 năm của Mendeleev lại một đợt tiếp nhữa được khẳng định.
Sau khi chứng kiến tận mắt xét nghiên cứu và phân tích hóa học tập đệ trình bởi các nhà khoa học tới từ Mỹ, Nhật và Nga, IUPAC đã xác nhận 4 nguyên tố sở hữu số hiệu nguyên tử 113, 115, 117 với 118 là đáp ứng nhu cầu các tiêu chí để thay đổi nguyên tố bắt đầu được vạc hiện. Đây mọi là những nguyên tố nặng nhất trong bảng tuần hoàn và trước đó chưa từng được thấy tồn tại phía bên ngoài phòng thí nghiệm. Vì sao là do chúng khá kém bền vững, chỉ rất có thể tạo ra trong phòng nghiên cứu bằng những tổng đúng theo từ những hạt nhân khối lượng nhẹ hơn và thiệt ra, bọn chúng chỉ tồn tại không tới một giây trước lúc bị vỡ lẽ ra thành các nguyên tố khác.
Như vậy có thể thấy, trong tổng số 118 nguyên tố chất hóa học thì bao gồm đến 98 nguyên tố lộ diện trong tự nhiên; trăng tròn nguyên tố còn sót lại từ Ensteini cho tới Oganesson, chỉ lộ diện trong phép tổng hợp nhân tạo. Trong những 98 nguyên tố đó, 84 nhân tố nguyên thủy, nghĩa là xuất hiện trước khi Trái đất sinh ra và 14 nguyên tố còn lại chỉ xuất hiện thêm trong những chuỗi phân rã của các nguyên tố nguyên thủy. Không có nguyên tố như thế nào nặng hơn Einsteini (số hiệu 99) từng quan gần kề thấy cùng với lượng mô hình lớn ở dạng tinh khiết.
Cách coi bảng tuần hoàn hóa học
+ Số nguyên tử: Hay còn gọi là số proton của 1 nguyên tố hóa học, là số proton được tìm thấy trong phân tử nhân của 1 nguyên tử. Là số năng lượng điện hạt nhân. Số nguyên tử giúp xác định duy tuyệt nhất một yếu tắc hóa học. Số nguyên tử cũng thông qua số electron trong một nguyên tử th-nc về điện.
+ Nguyên tử khối trung bình: ngay gần như các nguyên tố hóa học là lếu hợp của tương đối nhiều đồng vị với tỷ lệ tỷ lệ số nguyên tử xác định. đề nghị nguyên tử khối của các nguyên tố có nhiều đồng vị là nguyên tử khối trung bình của lếu hợp các đồng vị tất cả tính đến tỷ lệ xác suất số nguyên tử tương ứng.
+ Độ âm điện: Độ âm điện của một nguyên tử là kỹ năng hút electron của nguyên tử đó khi tạo nên thành link hóa học. Quy tắc: Độ âm điện của nguyên tử yếu tắc càng lớn thì tính phi kim nguyên tố kia càng táo bạo và ngước lại
+ cấu hình electron: cấu hình electron nguyên tử cho biết sự phân bố những electron vào lớp vỏ nguyên tử ở những trạng thái năng lượng không giống nhau hay ở các vùng hiện hữu của chúng.
+ Số oxi hóa: Là số áp cho 1 nguyên tử hay nhóm nguyên tử. Dựa vào số oxi hóa, chúng ta cũng có thể nhận hiểu rằng số electron trao đổi lúc 1 chất bị thoái hóa hoặc bị khử vào một làm phản ứng.
+ tên nguyên tố: là một chất chất hóa học tinh khiết, bao gồm một kiểu nguyên tử, được riêng biệt bởi số hiệu nguyên tử, là số lượng proton có trong những hạt nhân.
+ ký kết hiệu hóa học: vào hóa học, cam kết hiệu là tên gọi viết tắt của một nguyên tố hóa học. Hình tượng cho các nguyên tố hóa học thường gồm 1 hoặc 2 chữ cái trong baeng chữ cái Latin và được viết với chữ cái đầu tiên viết hoa. Các biểu tượng trước đó cho những nguyên tố hóa học bắt đầu từ từ vựng truyền thống Latin cùng Hy Lạp.
Cách học tập thuộc bảng tuần hoàn

Cách ghi nhớ Bảng tuần hoàn chất hóa học
Cách một: học tập bảng tuần hoàn trải qua cách học truyền thống
– phân biệt các yếu tắc của mỗi nguyên tố: Một điều xứng đáng quan tâm nhất lúc sử dụng bảng tuần hoàn hóa học là bạn đọc phải nhận biết được số nguyên tử, nguyên tử khối trung bình, độ âm điện, cấu hình electron, số oxi hóa, thương hiệu nguyên tố, cam kết hiệu hóa học. Toàn bộ đều phía bên trong ô nguyên tố trên bảng tuần hoàn.
– học vài nguyên tố từng ngày: Đây là một cách học được tương đối nhều học sinh áp dụng. Đối với cùng một bảng tuần hoàn hơn 100 nguyên tố rất cạnh tranh nhớ với các thông số đi kèm, thì việc phân bé dại ra để học nó giúp não bộ ghi lưu giữ được một cách tối đa với lâu dài. Đồng thời, lúc học những nguyên tố bắt đầu cũng cần phải ôn lại những nguyên tố cũ, tránh vấn đề không đề cập đến sẽ rất dễ quên.
– Dán những bảng tuần hoàn chất hóa học ở khắp nơi: Một vấn đề đề ra là con bạn không phải luôn luôn dành thời gian cho việc học, dường như họ còn cần làm các các bước khác nữa. Một phương pháp làm khá mới mẻ được áp dụng là dán bảng tuần hoàn chất hóa học ở khắp phần đông nơi trong nhà. Khi đó bạn cũng có thể vừa thao tác làm việc và vừa học hành rồi. Khía cạnh khác, các bạn cần chuẩn bị một bảng tuần hoàn hóa học luôn luôn mang theo bên trên người, để bao giờ rảnh rỗi thì hoàn toàn có thể lấy ra đọc. Quả đúng là quá tiện lợi.
– làm cho thẻ ghi chú cho từng nguyên tố. Cách làm này giống như làm một tập flatcard vậy. Một khía cạnh ghi cam kết hiệu thương hiệu nguyên tố, một mặt đứng tên nguyên tố, team nguyên tố hoặc ký hiểu của nhóm đó chẳng hạn. Với cách học này, chúng ta cũng có thể mang flatcard đi khắp đa số nơi, nhân thể lợi, dễ dàng học với dễ ghi nhớ.
– Phân chia thời gian và bí quyết học vừa lòng lý: mọi cá nhân sẽ có một quỹ thời gian cho bản thân để cân xứng hơn cho câu hỏi học. Cạnh bên đó, cửa hàng chúng tôi rất khuyến khích bạn đọc trong việc chủ động học hỏi và chia sẻ và search hiểu. Học ở bất kể nơi đâu mà các bạn muốn, đối kháng giản có thể là học tập bảng tuần hoàn khi chúng ta đang bên trên xe buýt mang lại trường, học tập khi đang đến giờ ra chơi, học khi sẽ trong giờ ăn, …
Cách hai: sử dụng công cụ cung ứng trí nhớ
– sử dụng một vài mẹo để ghi lưu giữ bảng tuần hoàn.
+ câu nói quen thuộc: “Khi nào đề xuất may áo sát sắt nhớ sang phố hỏi cửa hàng Á Phi Âu” chắc hẳn không còn vượt xa lạ so với học sinh. Đây là câu nói dung để ghi ghi nhớ 16 nguyên tố chất hóa học trong dãy vận động hóa học của khiếp loại. Tên nguyên tố được “biến thể” linh hoạt dựa vào những chữ cái đầu tiên của nguyên tố kia giúp ích mang đến học sinh dễ dàng ghi nhớ con kiến thức. Theo đó, dãy chuyển động hóa học của kim loại bao gồm: F, Na, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au.
+ Mẹo ghi lưu giữ 6 yếu tắc hóa học đội IA: Li, Na, K, Rb, Cs, quảng bá được ghi nhớ trải qua câu nói quen thuộc “Lâu nay không thanh nhàn coi phim”.
+ Hay bài ca hóa trị được truyền từ cố kỉnh hệ học sinh này đến cầm cố hệ học sinh khác:
“Kali, I – ốt, Hidro
Natri với Bạc, Clo một loài
Là hóa trị 1 chúng ta ơi
Nhớ ghi mang lại rõ kẻo rồi phân vân
Magie, Chì, Kẽm, Thủy ngân
Canxi, Đồng ấy cũng gần Bải
Cuối cùng thêm chú Oxi
Hóa trị 2 ấy có gì khó khăn
Bác Nhôm hóa trị 3 lần
Ghi sâu trí nhớ khi cần phải có ngay
Cacbon, Silic này đây
Là hóa trị 4 không ngày làm sao quên
Sắt kia nói cũng thân quen tên
2, 3 tăng lên và giảm xuống thật phiền lắm thôi
Nito rắc rối nhất đời
1, 2, 3, 4 khi thời thiết bị 5
Lưu huỳnh lắm khi chơi khăm
Xuống 2, lên 51 khi nằm máy 4
Photpho nói tới không dư
Nếu ai hỏi mang lại thì hừ rằng 5
Em ơi cố gắng học chăm
Bài ca hóa trị trong cả năm cực kỳ cần”.
– Chơi các trò đùa trực con đường để ghi nhớ các nguyên tố hóa học: ở kề bên các giờ đồng hồ học căng thẳng thì yếu hèn tố học tập hành phối kết hợp với chơi nhởi là một điều cần thiết. Thay bởi học tập một giải pháp quá trang nghiêm trong một thời gian dài làm đầu óc quá trì trệ tạo phản tác dụng, các bạn đọc có thể áp dụng giải pháp vừa học vừa đùa bằng việc học nằm trong bảng tuần hoàn hóa học trải qua các trò chơi trực tuyến. Các trò đùa này hoàn toàn có thể kiểm tra đầu óc và cải thiện điểm số của bạn trước những kỳ thi quan lại trọng. Một trong những trang web có áp dụng trò đùa như: Scratch, Elemental Flash Cards Quiz, Fun
Brain, …
Bảng tuần hoàn hóa học của Mendeleev
Bảng tuần hoàn hóa học là phương thức dạng bảng hiển thị những nguyên tố hóa học bởi nhà hóa học Dimitri Mendeleev bạn Nga phát minh sáng tạo vào năm 1869. Ông ý định bảng để minh họa các xu thế định kỳ trong số thuộc tính của những nguyên tố. Bố cục của bảng tuần hoàn hóa học đang được tinh chỉnh và mở rộng dần theo thời gian khi có không ít nguyên tố mới được phát hiện sau đó. Mặc dù nhiên, các hiệ tượng cơ bản vẫn khá giống với thiết kế lúc đầu của Mendeleev.
Giá trị chủ công của bảng tuần hoàn là khả năng dự đoán đặc thù hóa học của một nguyên tố dựa vào vị trí của nó trên bảng. Thuộc tính của các nguyên tố khác nhau nếu xét theo chiều dọc củ của cột bảng hoặc theo hướng ngang dọc theo các hàng. Bảng tuần hoàn hóa học này áp dụng phổ cập trong lĩnh vực hóa học cũng giống như ứng dụng trong đồ gia dụng lý, kỹ thuật cùng công nghiệp, sinh học. Bảng tuần trả hóa học chính là kiến thức cần học trước tiên cho người mất gốc hóa học.
Ở Việt Nam, chính phủ nước nhà ra ra quyết định cho học viên tiếp cận cùng với môn hóa học từ khôn cùng sớm. Một trong các nội dung cơ phiên bản mà các học viên cần chũm chắc là bảng tuần trả hóa học. Vày vậy, ngay lập tức từ khi phi vào chương trình đào tạo, học sinh đã được tiếp cận tức thì bảng tuần hoàn hóa học này. Cụ thể là lớp 8, lớp 9, lớp 10. Và để khám phá sâu rộng vào chương trình đào tạo và huấn luyện liên quan cho bảng tuần hoàn hóa học của lớp 8, lớp 9, lớp 10, mong mỏi Quý bạn đọc có thể chăm chú vào các vấn đề sau:
Bảng nguyên tố hóa học lớp 8
Bước vào công tác Hóa học tập lớp 8, bởi vì đây là năm đầu tiên học sinh được tiếp xúc với môn học Hóa học buộc phải tất cả đều rất bỡ ngỡ. Thay do chọn phương thức cho học viên tiếp xúc ngay với bảng tuần hòa hóa học thì Bộ giáo dục và huấn luyện cùng các chuyên viên trong ngành Giáo dục chất nhận được học sinh tiếp xúc với một vài vấn đề tương quan đến bảng tuần trả trước. Điều này giúp học sinh hoàn toàn có thể tiếp xúc được mẫu căn bản, hiểu được từng bản chất một của vấn đề tiếp đến mới bước vào việc bao hàm bảng tuần trả nguyên tố hóa học.
Một số vấn đề mà học sinh lớp 8 có thể tiếp cận được, bao gồm:
Nguyên tử: trong đó, hiểu rõ các vụ việc như: Nguyên tử là gì? phân tử nhân nguyên tử là gì? giới thiệu chung về các lớp electron gồm trong nguyên tử.
Nguyên tố hóa học: vào đó, hiểu rõ các vụ việc như: Nguyên tố chất hóa học là gì? một số vấn đề liên quan đến nguyên tử khối; hay gồm bao hiêu yếu tắc hóa học?

Bảng nguyên tố chất hóa học lớp 9
Đến với hóa học lớp 9, học viên sẽ có một chiếc nhìn tổng quan hơn về bảng tuần trả hóa học. Với nền móng được đúc kết ra từ chất hóa học 8, học sinh đã rất có thể nắm được một lượng kỹ năng vừa đủ để có thể dung vừa lòng thêm lượng kiến thức Hóa học 9 vào khối óc của bao gồm mình.
Ở chất hóa học 9, học viên được tiếp cận rõ ràng và cụ thể hơn về bảng tuần hoàn hóa học. Chũm thể:
Sơ lược một vài kiến thức về bảng tuần hoàn những nguyên tố hóa học, bao gồm nguồn cội của bảng tuần hoàn; hiệ tượng sắp xếp các nguyên tố trong bảng tuần hoàn; cấu trúc của bảng tuần hoàn; Sự thay đổi tính chất của các nguyên tố trong bảng tuần hoàn; và cuối cùng là Ý nghĩa của bảng tuần hoàn những nguyên tố hóa học.
Ngoài ra, học viên được thêm những tiết ôn tập lại kỹ năng và các tiết luyện tập không giống nhau liên quan cho bảng tuần hoàn các nguyên tố hóa học để học sinh có thể làm quen, tiếp cận kiến thức và kỹ năng và nhớ kỹ năng được lâu dài hơn.

Bảng nguyên tố chất hóa học lớp 10
Sau hai năm làm thân quen với bảng tuần hoàn những nguyên tố hóa học, đi học Hóa học lớp 10 thì bắt buộc học viên phải cố chắc được kiến thức và kỹ năng của bảng tuần hoàn hóa học, và hơn thế nữa nữa, còn bắt buộc học sinh phải rứa chắc được con số nguyên tố, tên thành phần hóa học tất cả trong bảng tuần hoàn hóa học.
Trong kỹ năng Hóa học tập lớp 10, về bảng tuần trả hóa học giờ đây chủ yếu hèn chỉ đi sâu rộng về một số vấn đề, như: xuất phát về sự phát minh ra bảng tuần hoàn; phương pháp sắp xếp các nguyên tố trong bảng tuần hoàn; kết cấu của bảng tuần hoàn; Và sau cuối là các bài rèn luyện cơ bản, nâng cao.
Đến lever này, học sinh bắt buộc phải ghi nhận cách áp dụng bảng tuần hoàn chất hóa học vào bài xích tập để làm bài tập một biện pháp trôi chảy và mạch lạc; hơn thế nữa, rất có thể là phải áp dụng một biện pháp thành thành thục trong thực tế hàng ngày của học sinh.









