Nhằm giúp những em học viên có thêm nhiều tài liệu tham khảohoc247xin ra mắt tài liệu11 cách thức giải nhanh bài xích tập hóa học hữu cơ, vô cơ được biên soạn và tổng hòa hợp dưới đây. Tài liệu tất cả 11 phương thức giải sẽ giúp các em ôn tập thiệt tốt, củng cố kỹ năng và kiến thức bộ môn Hóa. Mong muốn đây sẽ là tài liệu tìm hiểu thêm hữu ích cho các em học sinh!
11 phương pháp giải nhanh bài xích tập hóa học hữu cơ, vô cơ
Phương pháp 1. Cách thức bảo toàn điện tích trong hóa học
1. Nội dung
+ Nguyên tử, phân tử, dung dịch luôn trung hòa về điện
+ trong nguyên tử: Số proton = số electron
+ trong dung dịch: số mol x năng lượng điện âm = số mol x điện tích dương
2. Phạm vi sử dụng
+ Đối với việc dung dịch
+ Trong câu hỏi có xuất hiện thêm các hóa học điện li mạnh: muối, axit, bazơ
Chú ý: Với phương pháp này thường thực hiện kết phù hợp với các cách thức sau:
+ Bảo toàn khối lượng
+ Bảo toàn nguyên tố
+ Viết phương trình ion rút gọn
`Phương pháp này thường chỉ áp dụng với bài toàn vô cơ
Phương pháp 2: cách thức bảo toàn electron vào hóa học
1. Nội dung
Trong phản ứng oxi hóa khử:
Số electron nhịn nhường = Số electron nhận
Số mol electron nhịn nhường = Số mol electron nhận
2. Phạm vi sử dụng
+ công ty yếu áp dụng cho việc oxi hóa khử những chất vô cơ
+ Khi gặp bài toán có sử dụng HNO3, H2SO4đặc nóng
Chú ý:
+ Xác định đúng đắn chất khử, chất oxi hóa ( phụ thuộc vào sự chuyển đổi số oxi hóa của những nguyên tử trong số chất)
+ hoàn toàn có thể áp dụng bảo toàn e cho một số phương trình, các phương trình hoặc toàn thể quá trình
+ xác minh các chất nhường với nhận e. Trường hợp xét cho 1 quá trình, chỉ cần xác định tinh thần đầu cùng trạng thái cuối số lão hóa của nguyên tố, hay không quan tâm đến trạng thái trung gian số thoái hóa của nguyên tố
+ lúc áp dụng phương thức bảo toàn e thường sử dụng kèm các phương pháp bảo toàn khác ( khối lượng, nguyên tố)
Phương pháp 3: phương thức bảo toàn cân nặng trong hóa học
1. Nội dung
mtham gia= msản phẩm
Đối với câu hỏi sử dụng những chất dư sau làm phản ứng ta có:
mtrước pư= msau pư
Chú ý: Đối với những phản ứng tạo thành thành chất kết tủa, cất cánh hơi, khối lượng dung dịch sẽ chuyển đổi sau phản ứng:
mdd sau làm phản ứng= mdd trước làm phản ứng+ mchất tan– mkết tủa– mbay hơi
2. Phạm vi sử dụng
Thường sử dụng phương thức bảo toàn khối lượng trong các bài toán sau:
+ Biết tổng khối lượng chất ban sơ ( tham gia) tính trọng lượng chất chế tạo thành sản phẩm hoặc ngược lại
+ Trong việc có n hóa học mà chúng ta biết trọng lượng của (n-1) hóa học ta sẽ tính được khối lượng chất còn lại
+ Những việc ta không thể khẳng định được số mol do băn khoăn được phân tử khối của các chất
Phương pháp 4: phương thức bảo toàn nguyên tố trong hóa học
1. Nội dung
Tổng số mol nguyên tử của một nhân tố X bất kỳ trước cùng sau phản nghịch ứng là luôn bằng nhau
2. Phạm vi sử dụng
Trong các phản ứng hóa học các nguyên tố luôn được bảo toàn
⇒ Số mol nguyên tử của một thành phần X bất cứ trước với sau làm phản ứng bởi nhau
Hầu hết tất cả các dạng bài xích tập đều hoàn toàn có thể sử dụng cách thức bảo toàn nguyên tố, nhất là các dạng bài hỗn hợp những chất, xảy ra chuyển đổi phức tạp. Hay sử dụng trong những trường thích hợp sau:
+ từ rất nhiều chất ban sơ tạo thành sản phẩm
Từ dữ kiện đề bài ⇒ số mol của yếu tắc X trong số chất ban sơ ⇒ tổng cộng mol trong sản phẩm ⇒ số mol sản phẩm
+ từ một chất ban sơ tạo thành tất cả hổn hợp nhiều sản phẩm
Từ dữ kiện đề bài bác ⇒ tổng số mol ban đầu, số mol của những hợp phần đã đến ⇒ số mol chất cần xác định
+ từ nhiều chất thuở đầu tạo thành nhiều sản phẩm
Đối với dạng bài bác này không cần thiết phải tìm đúng đắn số mol của từng chất, chỉ quan tâm:(sumlimits_^ n_X(tr) = sumlimits_^ n_X(sau) )( chỉ suy nghĩ tổng số mol của những nguyên tố trước với sau phản nghịch ứng)
+ Đốt cháy nhằm phân tích thành phần yếu tắc của hòa hợp chất
Chú ý:
+ hạn chế viết phương trình phản nghịch ứng nhưng viết sơ trang bị phản ứng trình diễn sự thay đổi của nguyên tố đang đề nghị quan tâm
+ tự số mol của nguyên tố bọn họ quan chổ chính giữa sẽ tính ra được số mol của các chất
+ Số mol yếu tắc trong hòa hợp chất ngay số nguyên tử của nguyên tố đó trong hợp chất nhân với số mol thích hợp chất đựng nguyên tố đó
Giả sử ta gồm hợp chất Ax
Bycó số mol là a (mol).
Bạn đang xem: Phương pháp giải nhanh hóa hữu cơ 11
Khi kia số mol thành phần A và B trong hợp hóa học là: n
A = ax (mol) cùng n
B = ay (mol)
Phương pháp 5: cách thức chọn đại lượng tương thích trong hóa học
1. Nội dung
Có một số bài toán tưởng như thiếu thốn dữ khiếu nại gây thuyệt vọng cho việc giám sát và đo lường vì vậy ta đề xuất tự chọn 1 đại lượng tương xứng để giao hàng cho việc giải toán
2. Phạm vi sử dụng
Khi họ gặp việc có dạng: Đề bài bác cho bên dưới dạng bao quát ( không tồn tại giá trị xác định) hoặc mang đến tỉ lệ thể tích tỉ trọng số mol các chất
+ lựa chọn mol nguyên tử hoặc phân tử chất tham gia
+ chọn một mol láo hợp những chất thâm nhập phản ứng
+ chọn đúng tỉ lệ thành phần lượng hóa học trong đầu bài bác đã cho
+ lựa chọn cho thông số kỹ thuật một giá chỉ trị phù hợp để đơn giản và dễ dàng phép tính
Phương pháp 6: phương thức đồ thị trong hóa học
Các dạng bài xích sử dụng khảo sát điều tra đồ thị:
+ việc cho CO2(SO2) chức năng với dung dịch Ca(OH)2hoặc Ba(OH)2
Phương trình:
CO2+ 2OH-→ CO32-+ H2O
Khi CO2dư liên tục xảy ra làm phản ứng
CO2+ CO32-→ HCO3-
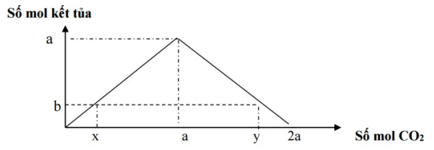
- hiện tại tượng: mở ra kết tủa tăng đột biến đến cực đại, tiếp nối tan dần đến hết
- n↓ rất đại= a = n
CO2
- nếu như 0 2
TH1: CO2thiếu tạo ra kết tủa không cực đại: n
CO2= a
TH2: CO2dư tạo nên kết tủa cực lớn sau kia hòa tung kết tủa:
n
CO2= 2a – n ↓= n
OH-- n ↓
+ bài toán tương quan tới muối Al3+tác dụng với OH-
Phương trình:
Al3++ 3OH-→ Al(OH)3
Nếu OH-dư tiếp tục xảy ra bội nghịch ứng:
Al(OH)3+ OH-→ Al
O2-+ 2H2O
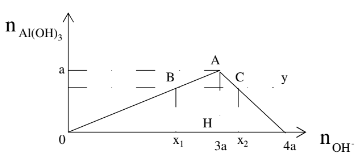
- hiện nay tượng: xuất hiện kết tủa tăng dần đến cực lớn sau đó tan dần cho hết
- n↓cực đại= a khi đó n
OH-= 3a
- trường hợp 0 -
TH1: n↓ tạo ra chưa cực đại n
OH-= 3n↓;
TH2: n↓ đạt cực lớn sau này lại tan lúc ấy n
OH-= 4a – n↓
+ muối bột Al
O2-tác dụng với dung dịch H+
Phương trình:
Al
O2-+ H++ H2O → Al(OH)3
Khi H+dư liên tục xảy ra bội phản ứng:
Al(OH)3+ 3H+→ Al3++ 3H2O
- hiện tượng: mở ra kết tủa tăng cao đến cực đại, tiếp nối tan cho đến hết
- n↓cực đại= a khi đó n
H+= a
- 0 ↓= n
H+
TH2: Kết tủa đạt cực to sau kia bị H+hòa tan: n
H+= 4a – 3n↓
Phương pháp 7: phương thức đường chéo cánh trong hóa học
1. Nội dung
+ phương pháp này áp dụng cho những bài toán tất cả hổn hợp chứa 2 thành phần cơ mà yêu cầu của bài xích là xác định tỉ lệ thân 2 nguyên tố đó.
+ Ta có thể sử dụng đặt ẩn – giải hệ để sửa chữa thay thế cho cách thức đường chéo, tuy nhiên áp dụng đường chéo hợp lí, đúng cách dán trong nhiều bài toán để giúp tốc độ làm bài xích nhanh hơn.
2. Phạm vi sử dụng
+ việc về đồng vị: Ta áp dụng sơ đồ vật đường chéo cho đại lượng cân nặng phân tử với số khối
+ câu hỏi hỗn phù hợp khí: Ta áp dụng sơ đồ đường chéo cánh cho tỉ trọng mol tương ứng với tỉ lệ chênh lệch phân tử khối các chất so với mức giá trị trung bình
+ vấn đề pha chế: Ta áp dụng sơ đồ dùng đường chéo cho các đại lượng C%, CM, d,…
+ bài toán xác định công thức, tính tỉ lệ những chất: Ta áp dụng cho các đại lượng, phân tử khối trung bình, số nguyên tử trung bình,…
Phương pháp 8: cách thức trung bình trong hóa học
1. Nội dung
Giả sử lếu hợp tất cả các thành phần A1,A2,A3,... Có khối lượng mol theo lần lượt là M1, M2, M3,…có số mol mỗi phần tử lần lượt là a1, a2, a3... Hoặc ta có tỷ lệ số mol mỗi bộ phận là x1, x2, x3,....
Ta và tính được trọng lượng mol vừa phải ( ) theo công thức:
(overline M = fracM_1a_1 + M_2a_2 + M_3a_3 + ...a_1 + a_2 + a_3 + ...)
Hay(overline M = M_1x_1 + M_2x_2 + M_3x_3 + ...) ( với x1 + x2 + x3 = 100%)
2. Phạm vi sử dụng
+ bài xích toán có khá nhiều hỗn vừa lòng có tính chất hóa học tựa như nhau
Thay vày ta viết những phương trình hóa học cho nhiều chất, thì ta gọi công thức trung bình và viết một phương trình đại diện
+ bài toán xác minh thành phần %
+ bài toán xác minh nguyên tố, phương pháp phân tử
Chú ý:
- một số trong những bài tập thường sẽ có sự kết hợp giữa cách thức trung bình và phương thức đường chéo để rút ngắn thời gian tính toán.
- với đa số giá trị vừa phải ta luôn có hệ thức(M_min le overline M le M_max ,(M_min,M_max)lần lượt là giá trị nhỏ nhất và lớn số 1 của đại lượng mang giá trị trung bình).
- Nếu các chất trong láo lếu hợp tất cả số mol bằng nhau ⇒ Gía trị trung bình bằng trung bình cộng và ngược lại
Phương pháp 9: phương pháp quy đổi trong hóa học
1. Nội dung
Quy đổi là phương pháp biến hóa toán học tập đưa bài toán ban đầu với một láo hợp những chất phức hợp trở thành một bài xích toán đơn giản và dễ dàng hơn, thông qua đó làm các phép tính trở phải ngắn gọn, dễ dàng dàng.
2. Phạm vi sử dụng
Khi gặp mặt các bài toán hỗn hợp những chất nhưng thực chất chỉ có 2 ( hoặc 3) nguyên tố:
+ bài toán về tất cả hổn hợp hợp chất của Fe, Cu,…
+ câu hỏi về tất cả hổn hợp đồng đẳng, thủy phân hóa, hiđro hóa, ankan hóa,…
Chú ý:
Số electron nhường, nhận không đổi
- Trong vượt trình giám sát và đo lường theo cách thức quy đổi nhiều khi ta gặp gỡ số âm đó là vì sự bù trừ trọng lượng của các chất trong láo lếu hợp. Vào trường vừa lòng này ta vẫn tính toán thông thường và tác dụng cuối cùng vẫn thỏa mãn.
Xem thêm: Nhạc kim jun see là ai? tiểu sử, sự nghiệp và đời tư vợ lâm chấn khang
- Khi trả định lếu láo hợp những chất thành một chất thì hóa học đó có thể không bao gồm thực, hệ số của các nguyên tử trong công thức rất có thể không buộc phải là số tự nhiên mà rất có thể là số thập phân dương.
- cách thức quy thay đổi mặc dù được xem là phương pháp rất hay dùng để làm giải quyết một vài bài toán liên quan đến Fe và hợp chất của fe ... Mặc dù nếu chỉ áp dụng cách thức quy thay đổi thì ta quan yếu giải toán nên những lúc áp dụng phương thức quy đổi ta rất cần phải kết hợp với các phương thức khác như:
+ Định pháp luật bảo toàn khối lượng
+ Định chế độ bảo toàn nguyên tố
+ Định luật bảo toàn electron
+ Định lao lý bảo toàn năng lượng điện tích
Phương pháp 10: cách thức sử dụng phương trình ion thu gọn trong hóa học
1. Nội dung
Phương trình hóa học thường xuyên được viết bên dưới hai dạng là phương trình hóa học ở dạng phân tử và dạng ion rút gọn. Ngoài bài toán thể hiện nay đúng thực chất của phản ứng hóa học, phương trình ion thu gọn còn khiến cho giải nhanh không hề ít dạng bài tập khóa đào tạo và huấn luyện không thể giải theo những phương trình chất hóa học ở dạng phân tử.
2. Phạm vi sử dụng
Vì để rút gọn phương trình phân tử thành phương trình ion rút gọn ta sử dụng cho các chất năng lượng điện li mạnh, vị vậy phương thức này áp dụng chủ yếu cho những chất axit bazơ, muối trong vô sinh ( các chất hữu cơ hay là hóa học điện li yếu)
+ phản ứng axit, bazơ và khẳng định p
H của dung dịch
+ vấn đề CO2, SO2tác dụng với dung dịch bazơ
+ bài xích toán liên quan tới oxit, hiđroxit lưỡng tính
+ việc chất khử chức năng với dung dịch chứa H+và NO3-
+ các phản ứng nghỉ ngơi dạng ion thu gọn tạo ra chất kết tủa, chất dễ cất cánh hơi, chất điện li yếu
Phương pháp 11: phương pháp tăng giảm trọng lượng trong hóa học
1. Nội dung
+ đông đảo sự thay đổi hóa học ( được mô tả bằng phương trình phản bội ứng) đều sở hữu liên quan đến tăng hoặc giảm khối lượng.
+ nhờ vào sự tăng hoặc giảm khối lượng khi gửi 1 mol chất X thành 1 hoặc các mol chất Y ( rất có thể qua các giai đoạn trung gian) ta dễ ợt tính được số mol của các chất và ngược lại. Từ bỏ số mol hoặc quan thông số mol của các chất ta sẽ biết được sự tăng giảm khối lượng của các chất X,Y.
Chú ý:
+ khẳng định đúng mối contact tỉ lệ giữa các chất sẽ biết cùng với chất buộc phải xác định, sử dụng định nguyên lý bảo toàn nguyên tố nhằm xác định đúng chuẩn tỉ lệ này
+ xác định khi gửi từ hóa học X thành Y ( hoặc ngược lại) thì trọng lượng tăng lên hoặc giảm đi theo tỉ lệ phản ứng với theo đề bài cho
+ Lập phương trình toán học nhằm giải
2. Phạm vi sử dụng
+ các bài toán hỗn hợp nhiều chất.
+ chưa chắc chắn rõ phản nghịch ứng xẩy ra hoàn toàn hay là không hoàn toàn
+ các bài toán tương quan đến phản nghịch ứng thế
+ các bài toán về nhiệt luyện
...




Chia sẻ:




Phân Dạng Và phương thức Giải Nhanh bài xích Tập Hóa Học 11 bởi vì các tác giả Nguyễn phái nam Khánh, Lê Cảnh Hoàn, Nguyễn Quốc Việt, Trần Quốc Chính, Lê Thăng Long biên soạn.
Nội dung sách bao gồm 8 chương:
- Chương 1: Sự điện li
- Chương 2: Nhóm Nitơ
- Chương 3: Nhóm Cacbon
- Chương 4: Đại cươn vế hóa hữu cơ
- Chương 5: Hiđrocacbon no
- Chương 6: Hiđrocacbon không no
- Chương 7: Hiđrocacbon thơm. Nguồn gốc hiđrocacbon thiên nhiên
Chương 8: Dẫn xuất Halogen, Ancol - Phenol - Anđehit - Xeton - Axit cacbonxylic
THÔNG TIN và KHUYẾN MÃI
Có thể chúng ta quan tâm

Bài Tập bồi dưỡng Học Sinh giỏi Hóa học tập Lớp 11
Giá bán: 56.250 đ 75.000 đ

Kĩ Thuật Giải Nhanh vấn đề Hay Và khó khăn Hóa học tập 11
Giá bán: 93.750 đ 125.000 đ

Hóa học tập 11 Nâng Cao
Giá bán: 63.750 đ 85.000 đ

Hóa học tập Cơ phiên bản Và nâng cao Lớp 11
Giá bán: 33.750 đ 45.000 đ
Về Chu Văn Biên
cơ chế









